 Արյան պլազմայի օսմոսայիհ ճնշումը
Արյան պլազմայի օսմոսայիհ ճնշումը
Օսմոսային ճնշումը այն ուժն Է, որն ապահովում Է կիսաթափանցիկ թաղանթի միջով լուծիչի մոլեկուլների անցումը։ Այն կախված է լուծված նյութի խտությունից, մոլեկուլների և իոնների քանակից։
Արյան պլազմայում անօրգանական աղերի քանակը անհամեմատ փոքր է (0,9-1,0%), սակայն հիմնականում նրանցով է պայմանավորված պլազմայի օսմոսային ճնշումը,քանի որ այդ աղերի մոլեկուլային զանգվածն ավելի փոքր է, իսկ դիսոցման աստիճանը բարձր։ Կիսաթափանցիկ թաղանթները լուծիչների նկատմամբ ունեն եկկողմանի թափանցելիություն։ Թափանցման ուղղությունը կախված է թաղանթի երկու կողմերում գտնվող լուծույթների խտությունների տարբերությունից։ Օսմոսի օրենքի համաձայն լուծիչի (ջրի) մոլեկուլները թափանցում են ցածր խտությունից բարձր խտության կողմը։
Օրգանիզմում կիսաթափանցիկ թաղանթի դեր կատարում են բջիջների մեմբրանները։ Ներքին միջավայրի և բջիջների միջև ջրի բախշման և վերաբախշման պրոցեսում օսմոսային ճնշումը որոշիչ դեր ունի։ Արյունից դեպի բջիջներն են թափանցում համեմատաբար խոշոր մոլեկուլներ (ամինաթթուներ, ճարպեր, ածխաջրեր), իսկ բջջից հեռանում են ցածրամոլեկուլային նյութեր (CՕշ, ջուր, միզանյութ, միզաթթու և այլն)։ Միայն օսմոսի շնորհիվ կիսաթափանցիկ թաղանթներով սահմանազատված այդ միջավայրերում օսմոսային ճնշումը պահպանվում է դինամիկ հավասարակշռված վիճակում։ Երբ հյուսվածքային հեղուկում լուծված նյութերի խտությունը փոքրանում է, լուծիչի մոլեկուլները կիսաթափանցիկ թաղանթներով շարժվում են ինչպես դեպի արյուն, այնպես էլ դեպի հյուսվածքների բջիջների ցիտոպլազման և հավասարեցնում թաղանթների երկու կողմերում ստեղծված օսմոսային ճնշումների տարբերությունները։ Իսկ երբ միջբջջային հեղուկի մեջ լուծված նյութերի խտությունը մեծանում է, լուծիչի մոլեկուլների շարժումն ընթանում է հակառակ ուղղությամբ։
Համանման երեույթներ են զարգանում նաև էրիթրոցիտների և պլազմայի միջև, երբ արյան պլազմայի օսմոսային ճնշումը ենթարկվում է տատանման։
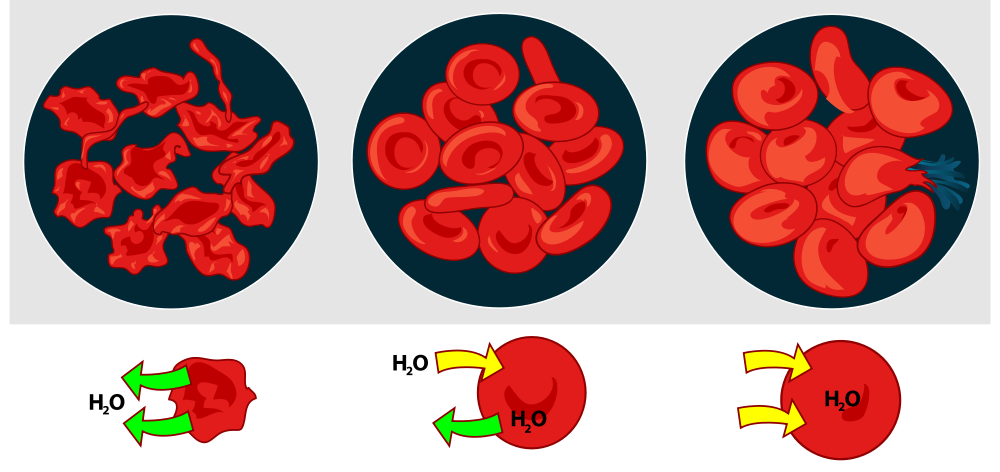
Արյան պլազմայի օսմոսային ճնշման նշանակությունը ցուցադրելու համար էրիթրոցիտները տեղավորում են NaCl-ի տարբեր խտության լուծույթների մեջ՝ (0,9%, 3,0%, 0,3%)։ 0,9% NaCl-ի լուծույթի մեջ էրիթրոցիտները պահպանում են իրենց չափը, ձևը, հետնաբար նաև ֆունկցիոնալ հատկությունները։ Ուստի այդ լուծույթն անվանում են ֆիզիոլոգիական Լուծույթ։ Նրա օսմոսային ճնշումը հավասար է պլազմայի օսմոսային ճնշմանը և կոչվում է իզոտոնիկ լուծույթ։ NaCl-ի 3,0% լուծույթում էրիթրոցիտներից ջրի մոլեկուլները դուրս են գալիս արտաքին միջավայր, ցիտոպլազմայի զանգվածը փոքրանում է, թաղանթը կնճռոտվում։ Բջջի այս վիճակը կոչվում է պլազսոլիզ իսկ լուծույթները, որոնց օսմոսային ճնշումը բարձր է արյան պլազմայի օսմոսային ճնշումից, կոչվում են հիպերտոնիկ։ Հակառակ երևույթն է նկատվում, օրինակ, NaCl-ի 0,3% լուծույթում։ Օսմոսի օրենքի համաձայն ջրի մոլեկուլները լուծույթից թափանցում են էրիթրոցիտի ցիտոպլազմայի մեջ, նրա զանգվածը մեծանում է, թաղանթը ձգվում է, և կարող, է պատռվել։ Այս դեպքում հեմոգլոբինի մոլեկուլները կլուծվեն միջավայրի մեջ։ Այդ երևույթը կոչվում է հեմոլիզ, իսկ լուծույթները, որոնց օսմոսային ճնշումը փոքր է արյան պլազմայի օսմոսային ճնշումից կոչվում են հիպոտոնիկ։ Եթե հեմոլիզը տեղի է ունենում արյան մեջ, ապա արյան պլազմայի գույնը դառնում է կարմրավուն և թափանցիկ տեսք է ունենում։ Նման արյունը փոխներարկման համար պիտանի չէ։
Հեմոլիզ կարող է առաջանալ ոչ միայն օսմոսային ճնշման տարբերության հետևանքով (օսմոսային հեմոլիզ), այլև կենսաբանական տարբեր նյութերից, ինչպես օրինակ՝որոշ օձերի թույներից,  հեմոլիզիններից (կենսաբանական հեմոլիզ)։ Հեմոլիզվում են նաև փոխներարկված արյան էրիթրոցիտները, անհամատեղելի արյան խմբերի կամ անհամատեղելի ռեզուսգործոնի փոխներարկման դեպքում (հետփոխներարկման հեմոլիզ)։ էրիթրոցիտների թաղանթները վնասվում են նաև պահածոյացած արյան սրվակը մեխանիկական ուժեղ հարվածների ենթարկելիս (մեխանիկական հեմոլիզ)։ Զանազան ճարպալուծ նյութեր, ինչպիսին են եթերը, քլորոֆորմը, մի շարք թթուներ, լուծում են արյան բջիջների թաղանթների լիպիդային շերտը և քայքայում այդ բջիջները (քիմիական հեմոլիզ)։ Արգելվում է պահածոյացված արյունը սառեցնել, որովհետև էրիթրոցիտների մեջ առաջացած սառույցի բյուրեղները վնասում են բջիջների թաղանթները (ջերմային հեմոլիզ)։ Արյան ծերացած էրիթրոցիտները կորցնում են իրենց ճկունությունը, դառնում գնդաձև և հեշտությամբ քայքայվում (ֆիզիոլոգիական հեմոլիզ)։ Հեմոլիզի թվարկած բոլոր ձևերից միայն այս վերջինն է համարվում բնականոն։
հեմոլիզիններից (կենսաբանական հեմոլիզ)։ Հեմոլիզվում են նաև փոխներարկված արյան էրիթրոցիտները, անհամատեղելի արյան խմբերի կամ անհամատեղելի ռեզուսգործոնի փոխներարկման դեպքում (հետփոխներարկման հեմոլիզ)։ էրիթրոցիտների թաղանթները վնասվում են նաև պահածոյացած արյան սրվակը մեխանիկական ուժեղ հարվածների ենթարկելիս (մեխանիկական հեմոլիզ)։ Զանազան ճարպալուծ նյութեր, ինչպիսին են եթերը, քլորոֆորմը, մի շարք թթուներ, լուծում են արյան բջիջների թաղանթների լիպիդային շերտը և քայքայում այդ բջիջները (քիմիական հեմոլիզ)։ Արգելվում է պահածոյացված արյունը սառեցնել, որովհետև էրիթրոցիտների մեջ առաջացած սառույցի բյուրեղները վնասում են բջիջների թաղանթները (ջերմային հեմոլիզ)։ Արյան ծերացած էրիթրոցիտները կորցնում են իրենց ճկունությունը, դառնում գնդաձև և հեշտությամբ քայքայվում (ֆիզիոլոգիական հեմոլիզ)։ Հեմոլիզի թվարկած բոլոր ձևերից միայն այս վերջինն է համարվում բնականոն։
էրիթրոցիտների հեմոլիզվելու ունակության աստիճանի մասին գաղափար կազմելու համար օգտվում են նրանց օսմոսային կայունության որոշման եղանակից։ Այդ նպատակով օգտագործում են NaCl-ի աստիճանաբար նվաղող հիպոտոնիկ լուծույթներ, որոնց մեջ սուզում են հավասար քանակությամբ հետազոտվող էրիթրոցիտներ։ Առողջ մարդու էրիթրոցիտների հեմոլիզն սկսվում է 0,5-0,4% NaCl-ի լուծույթում, իսկ 0,34-0,30% լուծույթում հեմոլիզվում են բոլոր էրիթրոցիտները։ էրիթրոցիտների թաղանթների ախտահարումով ուղեկցվող սակավարյունությունների ժամանակ նըրանց օսմոսային կայունությունը ընկնում է։
Օսմոսային ճնշումը արյան խստասահման ցուցանիշներից մեկն է։ Կենդանու արյան մեջ հիպերտոնիկ լուծույթ ներարկելուց հետո կարճ ժամանակամիջոցում արյան օսմոսային ճնշումը մեզի և քրտինքի օսմոսային ճնշման բարձրացման հաշվին արագությամբ կարգավորվում է։ Սննդի մեջ ընդունած ջրի կամ հանքային աղերի մեծ քանակության դեպքում փոփոխված արյան օսմոսային ճնշումը դարձյալ արագությամբ կարգավորվում է։
Օսմոսային ճնշման կարգավորումը իրականանում է նյարդահումորալ բարդ մեխանիզմներով, որոնց մեջ ընդգրկվում են արյան անոթների պատերի և ենթատեսաթմբի սուպրաօպտիկ կորիզի օսմոռեցեպտորները, նեյրոհիպոֆիզը, մակերիկամի կեղևը, երիկամները, քրտնագեղձերը։ Դրանց ֆունկցիաները ներկայացված են համապատասխան բաժիններում։
Արյան պլազմայի օսմոսային ճնշումը հավասար է 7,6մթն։ Նրա որոշումը կատարվում է սառնադիտական (կրիոսկոպիկ) եղանակով։ Իմանալով, որ պլազմայի սառեցման կետը ∆t=-0,56°C, կարելի է որոշել արյան պլազմայի խտությունը c-ն, որը հավասար է 0,3-ի։ Այդ մեծությունը տեղադրում են Կլապեյրոնի բանաձևի մեջ` P=cRT, որտեղ R-ը գազային հաստատունն է, իսկ T-ն բացարձակ ջերմաստիճանը, որին գումարում են նաև մարմնի ջերմաստիճանը (37°C): P=0,3-0,082-(273+37)=7,6մթն։
Էլեկտրոնային նյութի սկզբնաղբյուրը ՝ Doctors.am
Նյութի էլէկտրոնային տարբերակի իրավունքը պատկանում է Doctors.am կայքին












