 Տոլերանտությունը սեփականի հանդեպ և աուտոիմունիտետը: Իմունային համակարգի գործունեությունը կայանում է օտար մարմինների դեմ օրգանիզմի պաշտպանության մեջ: Այն չի գրոհում սեփական հյուսվածքները: Այս ընտրողական պատասխանի բացակայությունը սեփականի հանդեպ կոչվում է իմունաբանական տոլերանտություն: Այնուամենայնիվ, եթե այս գործառույթում առկա է խանգարում, ապա իմունային համակարգը պատասխան ռեակցիա է առաջացնում սեփականի հանդեպ, որը կոչվում է աուտոիմունիտետ: Աուտոիմունիտետը իմունային համակարգի խանգարումների մի տեսակն է, երբ իմուն համակարգը չի կարողանում տարբերակել սեփական և ոչ սեփական սպիտակուցները, ուստի կարող է պատասխան տալ նաև սեփականի հանդեպ:
Տոլերանտությունը սեփականի հանդեպ և աուտոիմունիտետը: Իմունային համակարգի գործունեությունը կայանում է օտար մարմինների դեմ օրգանիզմի պաշտպանության մեջ: Այն չի գրոհում սեփական հյուսվածքները: Այս ընտրողական պատասխանի բացակայությունը սեփականի հանդեպ կոչվում է իմունաբանական տոլերանտություն: Այնուամենայնիվ, եթե այս գործառույթում առկա է խանգարում, ապա իմունային համակարգը պատասխան ռեակցիա է առաջացնում սեփականի հանդեպ, որը կոչվում է աուտոիմունիտետ: Աուտոիմունիտետը իմունային համակարգի խանգարումների մի տեսակն է, երբ իմուն համակարգը չի կարողանում տարբերակել սեփական և ոչ սեփական սպիտակուցները, ուստի կարող է պատասխան տալ նաև սեփականի հանդեպ:
Տոլերանտությունը սեփականի հանդեպ առաջ ենթադրվում էր, որ զարգացման և հասունացման ընթացքում աուտոռեակտիվ B և T-լիմֆոցիտների կլոնալ դելեցիայի արդյունք է: Այս տեսակետը հիմա չի ընդունվում: Հակառակը, ենթադրվում է, որ բոլոր նորմալ առողջ անհատներն ունեն ինքնառեակտիվ հասուն շրջանառող լիմֆոցիտներ: Սակայն դա չի բերում աուտոիմունիտետի, քանի որ քանի որ նրանց ակտիվությունը կարգավորվում է կլոնալ աներգիայով կամ կլոնալ սուպրեսիայով: Այս կլոնալ աներգիայի խափանումը բերում է աուտոիմունիտետի զարգացման:
Աուտոիմունիտետը և հյուսվածքների վնասումը: Աուտոիմուն ռեակցիաները սովորաբար կայուն են, մնայուն և բերում են երկարատև հյուսվածքների վնասվածքի, ենթադրաբար քանի որ իմուն պատասխան առաջացնող սեփական հակածինները կարող են հեռացվել օրգանիզմից միայն դրանք արտադրող բջիջների ոչնչացումից հետո: Աուտոիմուն ռեակցիան կարող է լուրջ վնաս հասցնել բջիջներին, օրգաններին կամ հյուսվածքներին, որը երբեմն կարող է մահացու լինել: Աուտոիմուն ռեակցիաները բերում են մի խումբ հիվանդությունների առաջացման, որոնք կոչվում են աուտոիմուն հիվանդություններ: Դրանք երկարատև և հյուծող հիվանդություններ են: Աուտոիմուն հիվանդությունների ժամանակ հյուսվածքների վնասման մեխանիզմները նույնն են, ինչ որ պաշտպանական իմունիտետի և ալերգիայի ժամանակ, բացառությամբ IgE-միջնորդված ռեակցիաների: Այսպիսով հյուսվածքի կամ բջջի վնասումը կարող է առաջանալ և աուտոհակամարմնով և T-լիմֆոցիտով: Մարդկանց մոտ աուտոիմունիտետը սովորաբար սկսվում է ինքնաբերաբար: Դա նշանակում է, որ մենք չգիտենք, թե ինչ իրադարձություններ են սկզբնավորում իմուն ռեակցիան սեփականի հանդեպ: Այսպիսով, աուտոիմուն հիվանդությունները հիմնականում ունեն անհայտ ծագում, բայց հայտնի է, որ նրանց մանիֆեստացիայի և ծանրության համար նշանակություն ունեն հետևյալ գործոնները.
-ժառանգական նախատրամադրվածությունը,
-հորմոնային գործոնները,
-միջավայրի հրահրիչները,
-վարակը,
-դեղամիջոցները կամ թույները,
-սննդակարգը:
Վարակը
Վարակի առկայության և աուտոիմունիտետի սկսվելու միջև կա հստակ կապ ` ցույց տալով մանրէներն ունեն վճռորոշ դեր այս գործընթացում: Փորձնական կենդանիների վրաաուտոիմուն հիվանդություն կարելի է ստանալ` խառնելով հյուսվածքները ուժեղ ադյուվանտների հետ, որոնք պարունակում են մանրէներ և ներարկելով գենետիկորեն նույնական կենդանու մեջ:
Ժառանգական նախատրամադրվածությունը
Ժառանգական գործոնների դերն ապացուցված է մի շարք իմբրեդ կենդանիների միջոցով, որոնց մոտ բարձր է որոշակի աուտոիմուն հիվանդություններ ունենալու հաճախությունը: NOD (nonobese diabetes) մկների իմբրեդ գծի մոտ և BB առնետների գծի մոտ գրեթե բոլոր կենդանիները ունենում են ենթաստամոքսային գեղձի կղզյակների աուտոիմուն բորբոքում և քայքայում և շաքարային դիաբետ մինչև 6 ամսական հասակը: NZB (New Zealand black) գծի բոլոր մկները ի վերջո ունենում են աուտոիմուն հեմոլիտիկ անեմիա և հիբրիդների (B W) մեծ մասը, որոնք ստացվում են խաչասերելով NZB գծի մկանը այլ մկան հետ` NZW (New Zealand White), զարգացնում են ՀԿԳ-ին նման համախտանիշ:
HLA և աուտոիմունիտետ
Այս հիվանդությունների գենետիկական հիմքը մարդկանց մոտ ասոցիացվում է որոշակի HLA-ների հետ: Որոշակի աուտոիմուն հիվանդություններով տառապող անհատների մոտ HLA-որոշ հապլոտիպեր ավելի հաճախ են հանդիպում, քան առողջների մոտ: Շատ աուտոիմուն հիվանդություններ կապակցված են HLA - գեների հետ: MHC-գենոտիպի հետ կապը գնահատվում է` հիվանդների մոտ տարբեր ալելների հանդիպման հաճախականությունը համեմատելով նորմալ բնակչության հետ, օր.`շաքարային դիաբետը հստակորեն ավելի հաճախ է հանդիպում HLA-DR3 կամ DR4 ունեցող մարդկանց մոտ և առավելագույնը` երբ դրսևորված են երկու գեներն էլ: Հիմնականում աուտոիմուն հիվանդությունները կապակցված են MHC II ալելների հետ, բայց որոշ դեպքերում կապը հայտնաբերված է MHC I դասի գեների հետ: Բացի այս հստակ դրական ասոցիացիաների` հայտնաբերված են նաև որոշ բացասական ասոցիացիաներ այլ ալելների հետ: Օր.` ինսուլին-կախյալ շաքարային դիաբետը չի հանդիպում այն անձանց մոտ, ովքեր ունեն HLA-DR5 հապլոտիպը: Այսօր HLA-կապակցման բնույթն ավելի արագ է բացահայտվում, քանի որ օգտագործվում են ավելի ճշտգրիտ և արագ մեթոդ` պոլիմերազային շղթայական ռեակցիան: Օր.` կա ուժեղ կապ DQβ և ինսուլին-կախյալ շաքարային դիաբետի միջև: Նորմալ DQβ հաջորդականությունը ունի ասպարտաթթու 57-րդ դրությունում, մինչդեռ շաքարախտով հիվանդների մոտ այն փոխարինված է վալինով, սերինով կամ ալանինով:
Այնուամենայնիվ, MHC-գենոտիպը միայնակ չի կարող կանխորոշել, թե տվյալ անհատը կունենա աուտոիմուն հիվանդություն, թե ոչ: Այս կորելացիաների նշանակությունը պարզ չէ, բայց շատ հավանական է, որ նրանք արտացոլում են վճռորոշ դերը T-լիմֆոցիտին հակածնի ներկայացման գործընթացում: Օր.` դրական կապակցված MHC II մոլեկուլը ենթադրվում է` ավելի արդյունավետ է կապում և ներկայացնում որոշակի սեփական սպիտակուցը Th-բջիջներին: Ընդհակառակը, բացասական կապակցված MHC ալելը (ինչպիսին է HLA-DR5-ը դիաբետի ժամանակ) կարող է ունենալ հաջորդականություն, որը նման է որոշակի պեպտիդի, ուստի տոլերանտություն է առաջացնում նրա հանդեպ` կանխելով աուտոիմուն պատասխանը:
Հորմոնալ գործոնները
Հիվանդի հորմոնալ վիճակը ևս մեկ շատ կարևոր լրացուցիչ գործոն է հիվանդության նախատրամադրության համար: Շատ աուտոիմուն հիվանդություններ ունեն արտահայտված գենդերային տարբերություն: Այդ տարբերությունը ամենամեծն է սեռական հասունացման ժամանակ հիվանդության դրսևորման համար, քանի որ այդ ժամանակ այդ հորմոնների մակարդակը ամենաբարձրն է: Ավելին, աուտոիմուն հիվանդություններ, որոնք ավելի տարածված են կանանց մոտ, ցույց են տալիս հիվանդացությոան աճ ակտիվ վերարտադրողության տարիքում, երբ կնոջ օրգանիզմում նկատվում է էստրոգենների և պրոգեստերոնի առավելագույն արտադրություն: Աուտոիմուն հիվանդությունները միջնորդվում են մնայուն ադապտիվ իմուն պատասխանով դեպի սեփական հակածինները: Յուրաքանչյուր աուտոիմուն հիվանդություն ունի բնորոշ պաթոգենեզ, որը ներառում է հյուսվածքի վնասման 4 մեխանիզմներից մեկը կամ մի քանիսը: Յուրահատուկ հակածինը կամ հակածինները, որոնց դեմ ուղղված է աուտոիմուն հիվանդությունը և մեխանիզմը, որի միջոցով վնասվում է հակածին կրող հյուսվածքը, պայմանավորում են հիվանդության ախտաբանությունը: Աուտոիմուն հիվանդությունները կարելի է դասակարգել որպես օրգան-սպեցիֆիկ և բազմաօրգանային` համակարգային հիվանդություններ: Օրգան-սպեցիֆիկ հիվանդությունների դեպքում ախտահարվում է մեկ հյուսվածք կամ օրգան, համակարգայինի դեպքում` բազմաթիվ օրգաններ:
Իմունաախտաբանությունը
Հիվանդությունը աուտոիմուն համարելու համար պետք է ցույց տալ, որ հյուսվածքի վնասումն առաջացվել է սեփական հակածնի հանդեպ իմունային ռեակցիայի արդյունքում: Աուտոիմուն հիվանդություններն առաջանում են աուտոհակամարմիններով կամ աուտոիմուն T-լիմֆոցիտներով:
Մեխանիզմը, որով աուտոհակամարմինները` IgM կամ IgG, առաջացնում են հյուսվածքի վնասում, տարբերվում են: Աուտոհակամարմինները կարող են ուղղակիորեն փոխազդել յուրահատուկ հյուսվածքի հետ` առաջացնելով բորբոքում և հյուսվածքի վնասում: Օր.` Գուդպասչերի համախտանիշի ժամանակ աուտոհակամարմիններ են առաջանում բազալ թաղանթի կոլագենի հանդեպ և կապվում են երիկամների կծիկների և թոքային ալվեոլների բազալ թաղանթներին` արագ հարաճող մահացու հիվանդության պատճառ դառնալով: Աուտոիմուն հեմոլիտիկ անեմիայի ժամանակ աուտոհակամարմիններ առաջանում են էրիթրոցիտների սեփական հակածինների հանդեպ, որը բերում է նրանց քայքայման, քանի որ հակամարմիններով շրջապատված էրիթրոցիտները քայքայվում են կոմպլեմենտով կամ հեռացվում Fc-ընկալիչ կրող մակրոֆագերով: Կոմպլեմենտի կուտակումը բջջի մակերեսին նույնպես նպաստում է մակրոֆագի կողմից բջջի արագ էլիմինացիային, քանի որ նրանք կոմպլեմենտի նկատմամբ նույնպես ունեն ընկալիչներ:
Աուտոհակամարմինները կարող են կապվել մակերեսային ընկալիչների հետ և անմիջականորեն խափանել նրանց գործունեությունը: Օր.` չարորակ միասթենիայի պատճառը նյարդամկանային փոխանցման մասնակցող ացետիլխոլինի ընկալիչի a-ենթամիավորի նկատմամբ աուտոհակամարմինների առաջացումն է. այս հակամարմինները կապվում են ընկալիչին` առանց այն ակտիվացնելու և բերում են նրա քայքայման: Քանի որ մկանների վրա ընկալիչների քանակը պակասում է, ապա մկանը ավելի թույլ պատասխան է տալիս շարժիչ նեյրոնների կողմից արտադրվող ացետիլխոլինին: Միասթենիայով հիվանդների մոտ զարգանում է հարաճող թուլություն և նրանք մահանում են իրենց աուտոիմուն հիվանդության հետևանքով: Այն հիվանդությունների ժամանակ, երբ հակամարմիններ առաջանում են բջջային ընկալիչների հանդեպ, այդ հակամարմինները կարող են գործել որպես ագոնիստներ, որոնք խթանում, կամ որպես անտագոնիստներ, որոնք ընկճում են ընկալիչը: Ինսուլինի ընկալիչի հանդեպ տարբեր հակամարմիններ կարող են կամ խթանել կամ ընկճել նրա ազդեցությունը: Սա II-տիպի գերզգայունության ռեակցիա է: Մյուս ուղին իմունային համալիրների խրոնիկական առաջացումն է, որը բերում է կոմպլեմենտի ակտիվացման և մակրոֆագերի ու նեյտրոֆիլների ակտիվացման, որոնք արտադրում են պրոտեոլիտիկ ֆերմենտներ և բերում հյուսվածքի վնասման համակարգային աուտոիմուն հիվանդությունների ժամանակ: Այս մեխանիզմը կոչվում է III-տիպի գերզգայունություն: Ինչպես կարող են իմունային համալիրները դառնալ վնասակար և առաջացնել հյուսվածքի վնասում:
Իմունային համալիրների պաթոգենության վրա ազդող գործոններ
-Հակածնի քանակը.նորմայում իմուն կոմպլեքսները արդյունավետ մաքրվում են օրգանիզմից կոմպլեմենտի ընկալիչներ և Fc-ընկալիչներ կրող բջիջների միջոցով և քիչ են վնասում հյուսվածքները: Այնուամենայնիվ, երբ մեծ քանակով հակածին է ներարկվում, ապա առաջանում են մեծ քանակով փոքր իմունային համալիրներ, որոնք խուսափում են այս մեխանիզմից: Որոշակի աուտոիմուն հիվանդությունների ժամանակ, ինչպես նաև խրոնիկական վարակների ժամանակ իմունային համալիրները երկար մնում են օրգանիզմում և կարող են ծանր վնաս տալ հյուսվածքներին: Օր.` համակարգային կարմիր գայլախտի ժամանակ հակածնի աղբյուրը ներսից է, ուստի շարունակաբար առաջանում են փոքր իմունային համալիրների մեծ քանակներ և նստում երիկամների, ուղեղի, հոդերի և այլ հյուսվածքների փոքր անոթների պատին` բերելով կոմպլեմենտի կապման և ֆագոցիտների ակտիվացման: Տարբեր օրգանների անոթների պատի բորբոքումը տարբեր վնաս է հասցնում և անգամ հիվանդի մահվան կարող է բերել.
-իմունային համալիրների չափսը
-հակածնի բնույթը
-հակամարմինների դասը
-կոմպլեմենտ կապելու ունակությունը
-հիվանդի կոմպլեմենտի ունակությունը լուծել համալիրները: Համալիրները հաճախ նստում են երիկամներում, մաշկում, հոդերում և նյարդային համակարգում:
Ոչ բոլոր աուտոիմուն հիվանդություններն են միջնորդված հակամարմիններով: Երբեմն գործընթացի մեջ են ներգրավվում աուտոռեակտիվ T-բջիջները: Ավելին, կարծես թե այս բջիջներն անհրաժեշտ են պահպանելու համար բոլոր աուտոհակամարմնային պատասխանները: Օր.` ծանր միասթենիայով հիվանդի մոտ առկա են աուտոռեակտիվ Th CD4+ բջիջներ, որոնք արտադրում են IL-4` ազդանշան տալով B-բջջին, որպեսզի վերջինս արտադրի աուտոհակամարմիններ: Կան վկայություններ, որ ինսուլին-կախյալ շաքարային դիաբետի ախտածագման մեջ կարևոր նշանակություն ունեն բորբոքային CD4+ բջիջները և աուտոիմուն CD8+ T-բջիջները: Ենթաստամոքսային գեղձի ինսուլին արտադրող β-բջիջները ընտրողաբար քայքայվում են սպեցիֆիկ T-բջիջների կողմից, որոնք հիմնականում CD8+ բջիջներ են, և հիվանդության ռեցիդիվը կարելի է կանխել ցիկլոսպորին-A-ով, որն ընկճում է այդ բջիջների ակտիվացումը:
Ռևմատոիդ արթրիտը բարդ աուտոիմուն հիվանդություն է: Այն միջնորդվում է բորբոքային CD4+-բջիջների արտադրությամբ, որոնք յուրահատուկ են հոդային հակածինների հանդեպ. սա բերում է լիմֆոկինների արտադրությանը, որն էլ առաջացնում է տեղային բորբոքում հոդի ներսում` այտուցի առաջացմամբ, պոլիմորֆնուկլեար բջիջների և մակրոֆագերի կուտակմամբ, հոդի աճառի քայքայմամբ և ի վերջո հոդի դեստրուկցիայով: Ռևմատոիդ արթրիտի ախտածնության մեջ ներգրավված են նաև աուտոհակամարմիններ, որոնք հաճախ IgM և IgG դասի հակա-IgG հակամարմիններ են և կոչվում են ռևմատոիդ գործոն:
Աուտոիմունիտետի մեխանիզմները
-Th1-բջիջները և նրանց կողմից արտադրված ցիտոկինները (IL-2, TNF-a IFN-g) նպաստում են աուտոիմունիտետի զարգացմանը: Th2-բջիջները և IL-4-ը մյուս կողմից պաշտպանում են աուտոիմունիտետի հարաճից:
-Հակածնի ճանաչմանը և ներկայացմանը մասնակցող TCR-ի և MHC-ի որոշակի մոլեկուլային առանձնահատկություններ ընկած են աուտոիմունիտետի հիմքում: Օր.` TCR-ի որոշ v-դոմենների բարձր էքսպրեսիան ասոցիացվում է ծանր միասթենիայի և բազմակի սկլերոզի առաջացման բարձր ռիսկի հետ:
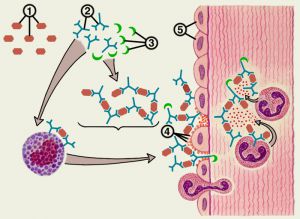
Կա, իհարկե, նաև ուժեղ կապակցվածություն MHC-II որոշ ալելների և հիվանդությունների միջև:
Աուտոիմունիտետի զարգացման հնարավոր մեխանիզմները
1.սեկվեստրացված հակածինները
2.մոլեկուլային միմիկրիա
3.անհամապատասխան MHCII էքսպրեսիան
4.B-բջիջների պոլիկլոնալ ակտիվացումը
1.Սեկվեստրացված հակածինները
-Հայտնի է, որ մարդու օրգանիզմի որոշ հյուսվածքներ /սեռական գեղձերը, աչքերը, ուղեղը, վահանաձև գեղձը/ առանձնացված են արյան շրջանառությունից և ուստի իմուն համակարգի զարգացման ընթացքում նրանց հակածինները չեն շփվում T-լիմֆոցիտների հետ:
-Երբ այդ հիստոհեմատիկ պատնեշը վնասվում է և հակածինները մուտք են գործում արյուն, ապա նրանք իմունակոմպետենտ բջիջների կողմից ճանաչվում են օտար և նրանց դեմ ձևավորվում է աուտոիմուն պատասխան: Օր.` աչքի վնասումը և ոսպնյակի հակածինների արտազատումը բերում է հակամարմինների արտադրման: Միելինի հիմնական սպիտակուցի արտազատումը կարող է պատճառ դառնալ ցրված սկլերոզի:
2.Մոլեկուլային միմիկրիան
-Մի շարք վիրուսներ և բակտերիաներ ունեն հակածնային դետերմինանտներ, որոնք նույնական են կամ շատ նման մեր օրգանիզմի նորմալ բջջային բաղադրիչներին: Օր.` ստրեպտոկոկի հակածնի հանդեպ հակամարմինները խաչաձև փոխազդում են նաև սրտամկանի որոշ հակածինների հետ` առաջացնելով ռևմատիկ տենդ և ախտահարելով սրտամկանը և սրտի կապանները:
-Սեփական հակածինները նման են որոշ բակտերիալ և վիրուսային ծագման օտար հակածինների, ուստի առաջացած հակամարմինները բերում են աուտոիմունիտետի:
3.MHC մոլեկուլների անհամապատասխան էքսպրեսիան
Նորմայում հակածին ներկայացնող բջիջները էքսպրեսիայի են ենթարկում MHC II դասի մոլեկուլներ: Շատ անգամներ դրանք էքսպրեսիայի են ենթարկվում ոչ հակածին ներկայացնող բջիջների կողմից, որը բերում է Th-բջիջների զգայունացում սեփական բջիջների նկատմամբ: Դա բերում է աուտոիմունիտետի առաջացման: Օր.` առողջ ենթաստամոքսային β-բջիջները չունեն MHC II դասի սպիտակուցներ իրենց մակերեսին, բայց ունեն MHC I դասի մոլեկուլների շատ ցածր մակարդակ: Այնուամենայնիվ, ինսուլին-կախյալ շաքարային դիաբետով հիվանդների մոտ β-բջիջները էքսպրեսիայի են ենթարկում և MHC I և MHC II դասի մոլեկուլներ մեծ քանակով: MHC II դասի էքսպրեսիան ոչ հակածին ներկայացնող բջիջների վրա խթանվում է IFN-g-ի ազդեցությամբ: Ենթադրվում է, որ որևէ օրգանի վնասվածքը կամ վիրուսային վարակը բերում է բորբոքային գործընթացի և բարձրացնում IFN-g-ի մակարդակը: Դա էլ խթանում է MHC II դասի մոլեկուլների էքսպրեսիան ոչ հակածին ներկայացնող բջիջների վրա` բերելով անհամապատասխան Th-բջիջների ակտիվացման տարբեր աուտոհակածինների հանդեպ: Բացի IFN-g-ից` IL-1-ը և TNF-a-ն ուղղակիորեն իջեցնում են ինսուլինի արտադրությունը β-բջիջներում:
4.B-բջիջների պոլիկլոնալ ակտիվացումը
-B-բջիջների պոլիկլոնալ ակտիվացնողները խթանում են նրանց սեփական հակածինների հանդեպ` առաջացնելով աուտոիմուն ռեակցիա:
-Պոլիկլոնալ ակտիվատորներ կարող են հանդիսանալ որոշ վիրուսներ` ցիտոմեգալովիրուսը, Էբշտեյն-Բառի վիրուսը, նաև շատ գրամ բացասական բակտերիաներ:
5.Խրոնիկական վիրուսային վարակ
Ծնվելիս մկներին որոշ վիրուսներով վարակելու դեպքում /օր.` լիմֆոցիտային խորիոմենինգիտի վիրուսով/ նրանք դառնում են այդ վարակի ցմահ կրողներ` արտադրելով հակամարմիններ, վիրուսի հետ համալիր են առաջացնում` առանց վիրուսի վարակայնության չեզոքացման: Վիրուսի հակածինը աբսորբցիայի ենթարկվելով էրիթրոցիտի կամ այլ բջիջների վրա`նմանակում են սեփական հակածիններին, նրանց համակցությունը հակավիրուսային հակամարմինների հետ առաջացնում է խրոնիկ խանգարումներ, ինչպիսին է հեմոլիտիկ անեմիան: Այսպիսով, որոշ աուտոիմուն հիվանդություններ երկրորդային են վիրուսային վարակի նկատմամբ և ձևավորվում են օրգանիզմի կողմից չճանաչված խրոնիկական վիրուսային վարակի հետևանքով:
Աուտումուն հիվանդության բուժումը
Աուտոիմուն հիվանդությունների բուժման հիմքում ընկած է իմուն պատասխանի ընկճումը` ախտանիշները թեթևացնելու համար: Այդ կատարվում է մի քանի ուղիով`
-Օգտագործելով իմունոսուպրեսիվ դեղեր. չնայած կորտիկոստերոիդները, ազաթիոպրինը և ցիկլոֆոսֆամիդը և մյուսները օգտագործվել են լիմֆոցիտների պրոլիֆերացիան և իմուն պատասխանը ընկճելու համար, դրանք օգտագործելը ցանկալի չէ: Նրանք իմուն պատասխանի ամբողջական ընկճում են առաջացնում և հիվանդին դնում մեծ ռիսկի տակ: Համեմատաբար ավելի ընտրողաբար ազդող դեղեր` ցիկլոսպորին A-ն և FK506-ն են օգտագործվում:
-Թիմեկտոմիա. ծանր միասթենիայով հիվանդները հաճախ ունեն ուրցագեղձի հիպերպլազիա և երբեմն անգամ թիմոմա: Նման դեպքերում գեղձի հեռացումը մեծացնում է ախտադադարի հավանականությունը:
-Պլազմաֆերեզ. Այս գործողության ընթացքում հակամարմիններ պարունակող պլազման հեռացվում է օրգանիզմից, իսկ արյան տարրերը համապատասխան միջավայրի մեջ լցնելուց հետո հետ են վերադարձվում օրգանիզմ: Դա բերում է ախտանիշների կարճաժամկետ պակասման: Օգտագործվում է Գրեյվսի հիվանդության, ծանր միասթենիայի և համակարգային կարմիր գայլախտի բուժման մեջ:
-Հակացիտոկինային բուժում. հայտնի է, որ IL-1-ը, IL-6-ը և TNF-a-ն գլխավոր դերն են խաղում բորբոքման ինիցիացիայի մեջ:
Բնականաբար, այս ցիտոկինների ընկճումը ամենաօգտավետ մեթոդներից է բորբոքումը ընկճելու համար:
Ցիտոկինների ազդեցությունը կարելի է ընկճել հետևյալ կերպ.
1.ցիտոկինի չեզոքացումը լուծելի ընկալիչի կամ մոնոկլոնալ հակամարմնի օգնությամբ,
2.ընկալիչի պաշարում,
3.իմունակարգավորիչ ցիտոկինների օգնությամբ հակաբորբոքային ուղու խթանումը:
1.ցիտոկինի չեզոքացումը.
1ա. լուծելի ընկալիչի օգնությամբ. լուծելի ընկալիչների ֆիզիոլոգիական դերը շատ ցիտոկինների չեզոքացումն է, օր.` TNF-a-ն կապվում է իր ընկալիչներին, որոնք առկա են շատ բջիջների մակերեսին, այդ թվում` մոնոցիտների, մակրոֆագերի,T-բջիջների, սինովիալ ֆիբրոբլաստների, օստեոբլաստների և էնդոթելային բջիջների վրա: Կան TNF-ընկալիչի 2 տեսակ` p55-ը և p75-ը: p75-ընկալիչը ունի անմիջական խթանիչ դեր T-բջիջների բազմացման մեջ և TNF-a-միջնորդված բորբոքման ընկճման մեջ, մինչդեռ p55-ը ունի վճռորոշ դեր օրգանիզմի պաշտպանության և բորբոքային պատասխանի մեջ: Երկուսի լուծելի ձևերն էլ հետադարձ կապի մաս են կազմում, որը կարգավորում է TNF-ի բորբոքային գործունեությունը: Երկու տեսակն էլ առկա են մարմնի հեղուկներում: TNF-a-ի հարաբերական ավելցուկը նրա լուծելի ընկլալիչների հանդեպ երկարացնում է բորբոքումը: Ռեկոմբինանտ լուծելի ընկալիչներով բուժումը թույլ կտա ընկճել բորբոքումը: Բայց քանի որ այս ընկալիչներն ունեն շիճուկային կարճ կիսատրոհման պարբերություն, ապա այն պիտի կոնյուգացվի մարդկային IgG Fc-հատվածի հետ: Մեկ այլ տարբերակ է ընկալիչի պոլիմերացումը պոլիէթիլենգլիկոլով:
Կլինիկայում այժմ կիրառվում է էթաներսեպտը: Այն երկու սպիտակուցների ձուլվածք է. դրանք են երկու ռեկոմբինանտ p75-ընկալիչները ձուլված IgG1 Fc-հատվածի հետ: Այս դեղի դիմերային կառուցվածքը դարձնում է նրան 1000 անգամ ավելի արդյունավետ մոնոմեր կառուցվածքի հանդեպ: Այն մասնավորապես արդյունավետ է ռևմատոիդ արթրիտի, յուվենիլ ռևմատոիդ արթրիտի բուժման մեջ:
1բ. ցիտոկինների հանդեպ մոնոկլոնալ հակամարմիններ. ցիտոկինները չեզոքացնելու մեկ այլ տարբերակ է նրանց նկատմամբ հակամարմինների օգտագործումը: Օգտագործվում են խիմերային և հումանիզացված մոնոկլոնային հակամարմիններ. նրանք ավելի քիչ իմունոգեն են և ավելի հարմար օգտագործման համար:
Ինֆլիքսիմաբը խիմերային IgG1 հակամարմին է ուռուցքի նեկրոզի գործոնի հանդեպ: Այն մասնավորապես արդյունավետ օգտագործվում է ռևմատոիդ արթրիտի, պսորիազի բուժման ժամանակ:
2. Ընկալիչի անտագոնիզմ . ցիտոկինի ընկալիչի կապումը կարելի է կատարել բնական անտագոնիստի կամ ընկալիչի հանդեպ մոնոկլոնային հակամարմնի օգնությամբ, որով կարող է ընկճվել ցիտոկինի ազդեցությունը: Օր.` ցիտոկինային ընկալիչի պաշարիչ է ռեկոմբինանտ ինտերլեյկին-1-ի ընկալիչի անտագոնիստը: Այդ չափավոր թեթևացնում է ռևմատոիդ արթրիտով հիվանդների վիճակը կլինիկական փորձարկումներում: Ցույց է տրված, որ հակացիտոկինային բուժումը դանդաղեցնում է հիվանդության հարաճը: Այսօր ռեկոմբինանտ ինտերլեյկին-1-ի անտագոնիստը փորձարկվում է մեթոտրեքսատի հետ զուգակցմամբ: Թերությունը կարճ պլազմայի կիսատրոհման պարբերությունն է /վեց ժամ/, որը անհրաժեշտություն է ստեղծում հաճախակի նշանակում օրվա մեջ մեծ դեղաչափերով` պահպանելու բուժական ազդեցությունը:
3. Հակաբորբոքային ուղու ակտիվացումը. այնպիսի իմունակարգավորիչ ցիտոկիններ, ինչպիսիք են IL-10-ը և IL-4-ը, կարող են ընկճել բորբոքումը: Ցիտոկինները ցածր մոլեկուլային սպիտակուցներ են, գլիկոպրոտեիններ` կարճ կյանքի տևողությամբ: Ուստի այս ցիտոկինների պլազմայի խտությունը կայուն պահպանելը կարող է բարդ և թանկարժեք լինել: Կլինիկական փորձարկումները ռևմատոիդ արթրիտի դեպքում հիասթափեցնող են եղել. հնարավոր է, որ արդյունավետության պակասը կարճ կյանքի տևողության պատճառով է:
Մակրոլակտամներ. Սրանք նոր դասի դեղեր են և կոչվում են տեղային իմունոմոդուլյատորներ: Այս խմբի մեջ են ներառնված հետևյալ դեղերը` Տակրոլիմուս /Պրոտոպիկ/ և Պիմեկրոլիմուս /Էլիդել/:
1.Տակրոլիմուսը այս դասի առաջին ներկայացուցիչն է: Այն մակրոլիդ է, արտադրվում է Streptomyces tsukabensis սնկերի կողմից: Տակրոլիմուսը ընկճում է T-բջիջների հասունացումը և ակտիվացումը և ընկճում մի քանի ցիտոկինների գեների ակտիվացումը` կապվելով ցիտոզոլային սպիտակուցների հետ, որոնք կոչվում են մակրոֆիլիններ: Այս համալիրը պաշարում է կալցինեուրինը, ընկճում է ակտիվացված T-լիմֆոցիտների կորիզային գործոնի տրանսկրիպցիան` կանխելով IL-2, 4, 5-ի արտադրությունը, IL-8-ի ընկալիչների մակարդակը կերատինոցիտների վրա: Ներկայումս դեղն օգտագործվում է տարբեր դերմատոզների բուժման համար, մասնավորապես ատոպիկ դերմատիտի և որոշ աուտոիմուն հիվանդությունների` պսորիազի, տափակ որքինի, մաշկային կարմիր գայլախտի, դերմատոմիոզիտի, վիտիլիգոյի բուժման համար:
2.Պիմեկրոլիմուսը ասկոմիցինի կիսասինթետիկ արգասիք է: Այն նաև փոխազդում է մակրոֆիլին-12-ի հետ և ընկճում T-բջիջների խթանումը հակածին ներկայացնող բջիջների կողմից` ընկճելով և Th1-բջիջների ցիտոկինների` IL-2-ի և IFN-g-ի արտադրությունը և Th2-բջիջների ցիտոկինների` IL-4,10-ի արտադրությունը: Այն նաև ընկճում է պարարտ բջիջների կողմից հեքսոզամինիդազի, տրիպտազի, հիստամինի արտազատումը: Կլինիկական փորձերում կան տվյալներ, որ պիմեկրոլիմուսը արդյունավետ է ատոպիկ դերմատիտի և պսորիազի բուժման մեջ:
Ներերակային ներարկման իմունագլոբուլիններ. Վերջին տարիներին այս դեղերը /IGIV/ լայն կիրառում են ստանում կլինիկական իմունոլոգիայում: Նրանք կամ օգտագործվում են որպես փոխարինող բուժում առաջնային և երկրորդային իմունային անբավարարությունների ժամանակ, կամ որպես իմունակարգավորիչ միջոց աուտոիմուն հիվանդւթյունների ժամանակ:
1.Փոխարինող բուժում. արդյունավետությունը ցուցադրված է հետևյալ դեպքերում
-բնածին ագամմա- և հիպոգամմագլոբուլինեմիա,
-չդասակարգված փոփոխական իմունային անբավարարություն,
-ծանր համակցված իմունային անբավարարություն,
-Վիսկոտ-Օլդրիչի համախտանիշ,
-երկրորդային հիպոգամմագլոբուլինեմիա խրոնիկական լիմֆոլեյկոզով հիվանդների
և միելոմայով հիվանդների մոտ, ովքեր ունեն կրկնվող վարակներ:
Երեխաների դեղաչափը կազմում է 10գ, մեծահասակների համար 20-30գ յուրաքանչյուր 3-4 շաբաթը մեկ: ՄԻԱՎ-ը և այլ T-բջջային իմունային անբավարարությունները ցուցում չեն հանդիսանում IGIV-ով բուժման համար:
2.Իմունակարգավորիչ բուժում. Մի շարք ստուգիչ հետազոտություններում ապացուցված է IGIV արդյունավետությունը հետևյալ աուտոիմուն հիվանդությունների բուժման մեջ`
-աուտոիմուն թրոմբոցիտոպենիա,
-Կավասակիի համախտանիշ,
-ծանր միասթենիա,
-Գիեն-Բառռեի համախտանիշ /սուր իդիոպաթիկ պոլինեվրիտ/,
-ցրված սկլերոզ,
-բազմաօջախային շարժիչ նեյրոպաթիա,
-աուտոիմուն նեյրոպաթիա,
-հեմոֆիլիա /հակամարմիններ FVIII գործոնի հանդեպ/,
-խրոնիկ բորբոքային դեմիելինիզացնող պոլինեյրոպաթիա,
-ստերոիդ-կախյալ ասթմա,
-համակարգային կարմիր գայլախտ,
-ռևմատոիդ արթրիտ,
-Կրոնի հիվանդություն,
-խոցային կոլիտ,
-աուտոիմուն թիրեոիդիտ,
-վասկուլիտ,
-միոզիտ,
-յուվենիլ դիաբետ,
-հեմոլիտիկոուրեմիկ համախտանիշ:
Ներարկման իմունագլոբուլինների ազդեցության մեխանիզմը աուտոիմուն հիվանդությունների բուժման մեջ լիովին հայտնի չէ: Մեկ հիպոթեզի համաձայն նրանք ընկճում են աուտոհակամարմինների արտադրությունը հետադարձ կապի մեխանիզմով: Մեկ այլ հիպոթեզի համաձայն հակաիդիտիպիկ հակամարմինները, որոնք կան IGIV կազմում կապվում են հակածին ճանաչող BCR-ին և Fc-հատվածի նկատմամբ ընկալիչին B-լիմֆոցիտների վրա` բերելով այդ բջիջների գործառույթների ընկճման: Հակացուցումներ են հանդիսանում հոմոլոգ Ig նկատմամբ գերզգայունությունը, մասնավորապես ընտրողական IgA անբավարարությամբ հիվանդների մոտ IgA դեմ հակամարմինների առաջացումը: Ուստի ժամանակակից IGIV բաղադրության մեջ IgA և IgM մակարդակը պետք է չգերազանցի 100մգ/մլ-ը:
IGIV դեղաձևեր են` սանդոգլոբուլին /IgG-95%/, ցիտոտեկ, ինտրագլոբին F, պենտագլոբին N, մարդու իմունոգլոբուլին ներերակային ներարկման համար, հակաստաֆիլոկոկային մարդու իմունագլոբուլին, նորմալ g-գլոբուլին, իմունագլոբուլինների համալիր միացություններ: Նոր մոտեցումներ. Սրանք փորձարկման փուլում են և դեռ չեն օգտագործվում կլինիկայում`
1.MHC –մոլեկուլների պեպտիդների պաշարում. երբ աուտոհակածնի հաջորդականությունը հայտնի է, ապա կարելի է ստանալ սինթետիկ պեպտիդ, որը միայն մեկ կամ երկու ամինաթթվով է տարբերվում և դրանով կապել համապատասխան MHC մոլեկուլները:
2.Մոնոկլոնալ հակամարմիններ. հակաCD4 մոնոկլոնալ հակամարմինները բերում են լիմֆոցիտար ինֆիլտրացիայի անհայտացման և դիաբետի ախտանիշների վերացմանը, բայց քանի որ նրանք պաշարում են բոլոր Th-բջիջները, ապա առաջանում է ծանր իմունաընկճում:
Էլեկտրոնային նյութի սկզբնաղբյուրը ՝ Doctors.am
Նյութի էլէկտրոնային տարբերակի իրավունքը պատկանում է Doctors.am կայքին